 |
 |
這是國內首個針對FcRn靶點的臨床II期試驗資料。此次公佈的臨床結果,填補了國內長期以來在重症肌無力治療領域缺少高品質臨床研究的空白局面,也凸顯了公司雄厚的研發實力。
重症肌無力:巨大未被滿足的治療需求,用藥情況亟待解決
重症肌無力(MG)是一種由乙醯膽鹼受體(AChR)抗體介導、細胞免疫依賴、補體參與,累及神經肌肉接頭突觸後膜,引起神經肌肉接頭傳遞障礙,出現骨骼肌收縮無力的獲得性自身免疫性疾病。
體內致病性的IgG與神經肌肉接頭的突觸結合,進而抑制神經與肌肉之間的正常通信能力,導致肌無力的情況並持續加劇,可能僅局限於眼部肌肉,亦可能影響全身,包括呼吸相關肌肉並繼而導致生命危險。
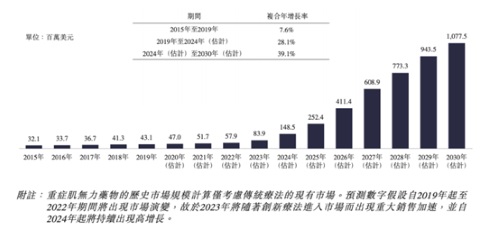
根據Frost&Sullivan資料統計顯示,中國 MG 的年度發病數量約為2.94萬,2015年至2019年,成年人MG的患病數由 15.71萬增至 16.56 萬。預計2024 年中國MG 患病數將達到 17.59 萬,預計2030 年將達 18.57萬。
傳統重症肌無力治療主要包括激素、傳統免疫抑制劑、胸腺切除術、靜脈內免疫球蛋白(IVIg)、血漿置換術。這些治療存在起效慢、療效不足、價格昂貴而且獲得性有限,以及長期使用導致嚴重不良反應等問題,因此急需安全有效的創新藥物。
FcRn療法作為新一代自身免疫性疾病抗體療法,在全球範圍內受到廣泛關注,並有多家國際知名生物製藥公司積極佈局。巴托利單抗在國內首先開展在抗FcRn療法上的臨床開發,填補了這一療法在中國人群療效驗證的空白, 同時填補了國內長期以來在重症肌無力治療領域缺少高品質臨床研究的空白局面。
巴托利單抗:中國首個進入臨床階段的FcRn抑制劑
FcRn在防止免疫球蛋白(IgG)抗體降解中起關鍵作用, 而高水準的致病性IgG抗體可引發多種自身免疫性疾病。公司候選產品巴托利單抗主要作用機制為通過阻斷FcRn IgG抗體的迴圈而達到加速降低IgG的目的。研究表明,抗FcRn療法有望治療60-70種由高水準致病性IgG引起的自身免疫性疾病。
相比較於傳統療法,和鉑醫藥選擇了FcRn為治療靶點,加速體內致病性自身抗體清除,對症下藥。去除這些阻礙信號傳遞的自身抗體是治療重症肌無力的最有效途徑,通過選擇調控體內抗體代謝,來實現快速降低自身抗體的治療目的。巴托利單抗治療顯示出更安全和更加高效的結果。
作為公司的核心候選產品,巴托利單抗是一款全人源單克隆抗體,可選擇性結合並抑制新生兒晶體片段受體(FcRn)。相較於人源化的FcRn抗體,全人源抗體在親和力和免疫原性風險上具有優勢。同時,該產品採用皮下注射的方式,相較於研發中的其他FcRn抗體的靜脈內注射療法,使用更方便,患者的依從性更高,安全性更好。可以說,巴托利單抗是一款超前的並經過精心設計的自身免疫性疾病療法產品,不論是與傳統療法相比,還是在FcRn療法領域當中,巴托利單抗都具有相當大的競爭優勢,具有成為同類最佳療法(Best-in-Class)的潛力。
更加值得關注的是,巴托利單抗是中國首個進入臨床階段的FcRn抑制劑。從公佈的資料來看,巴托利單抗在MG治療領域獲得了非常樂觀和令人振奮的臨床研究資料,有望填補中國MG長期未滿足的治療需求。
該項多中心、隨機、雙盲、安慰劑對照試驗入組了30名中至重度gMG受試者,分別接受巴托利單抗340 mg (10人)或680 mg (11人)或安慰劑(9人)。給藥週期為每週一次,持續6周(雙盲治療期),之後每隔一周接受340 mg,持續6周(開放標籤治療期)。
主要療效終點是重症肌無力日常生活 (MG-ADL) 量表相對於基線的改善。次要療效終點包括重症肌無力定量評分(QMG)、重症肌無力綜合量表 (MGC) 和重症肌無力生活品質量表 (MG-QoL15) 相對於基線的改善。其他終點包括安全性和耐受性、藥代動力學 (PK) 和藥效動力學 (PD) 。
與海外同類產品的臨床試驗資料相比,巴托利單抗在重症肌無力相關療效指標評分中亦展現出不俗實力,與海外同類主流療法結果具有一致性,且部分資料結果上表現優異。
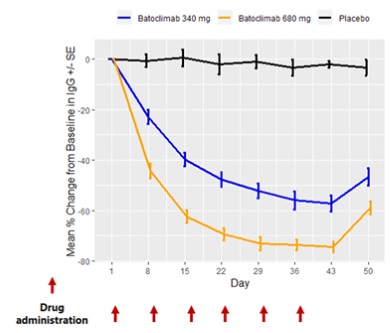
— 主要研究終點分析顯示,與安慰劑相比,巴托利單抗治療迅速起效,同時在用藥後第43天(最後一劑巴托利單抗後一周),重症肌無力日常生活(MG-ADL)量表分值較基線顯著降低,顯示出臨床和統計學意義的改善(p=0.043);
— 與安慰劑組對比,巴托利單抗在臨床療效的四項評估MG-ADL、QMG、MGC和 MG-QoL15,均顯示出起效快、顯著和持續的臨床改善;
— 巴托利單抗組中57%和76%的受試者表現出持續的臨床改善(連續6周,MG-ADL評分降低≥2分,QMG評分降低≥3分),而安慰劑組僅有33%和11%的受試者獲得MG-ADL和QMG方面的改善;
— 所有巴托利單抗組受試者均表現出顯著的IgG水準下降(在第43天,340 mg、680 mg治療組受試者的IgG水準較基線分別下降57%和74%),並與臨床獲益密切相關。
巴托利單抗治療總體上具有良好的安全性和耐受性,不良事件發生率與安慰劑組相當,大多數不良事件為輕度,且未發生嚴重不良事件及導致停藥的不良事件。
巴托利單抗獲得國家藥品監督管理局藥品審評中心(CDE)授予突破性治療藥物資格,這也是國內首款自身免疫性疾病產品獲國家突破性療法認定。目前,巴托利單抗已經獲得CDE認可進入臨床III期研究,2021下半年啟動。
小結
此次和鉑醫藥的核心產品巴托利單抗公佈的關於用於治療重度肌無力的臨床II期關鍵性資料令人振奮,也是繼獲得國家藥監局 「突破性治療」資格認定後又一重大利好消息。
從資本市場角度來看,對於創新藥企而言,每一次核心產品的重大里程碑事件都有望成為資本市場的催化劑,並伴隨著商業化進程的不斷推進之下逐步兌現。
長遠來看,中國自身免疫性疾病領域,非常需要有效藥物能夠為患者提供幫助與治療。根據Frost&Sullivan資料顯示,僅中國2030年自身免疫性疾病就將達到229億美元市場規模。核心重磅資產在未來將會陸續開花結果,為患者帶來創新療法,值得關注與期待。
Copyright 2021 亞太商訊. All rights reserved. (via SEAPRWire)